SAÚDE
09/02/2024 08H25
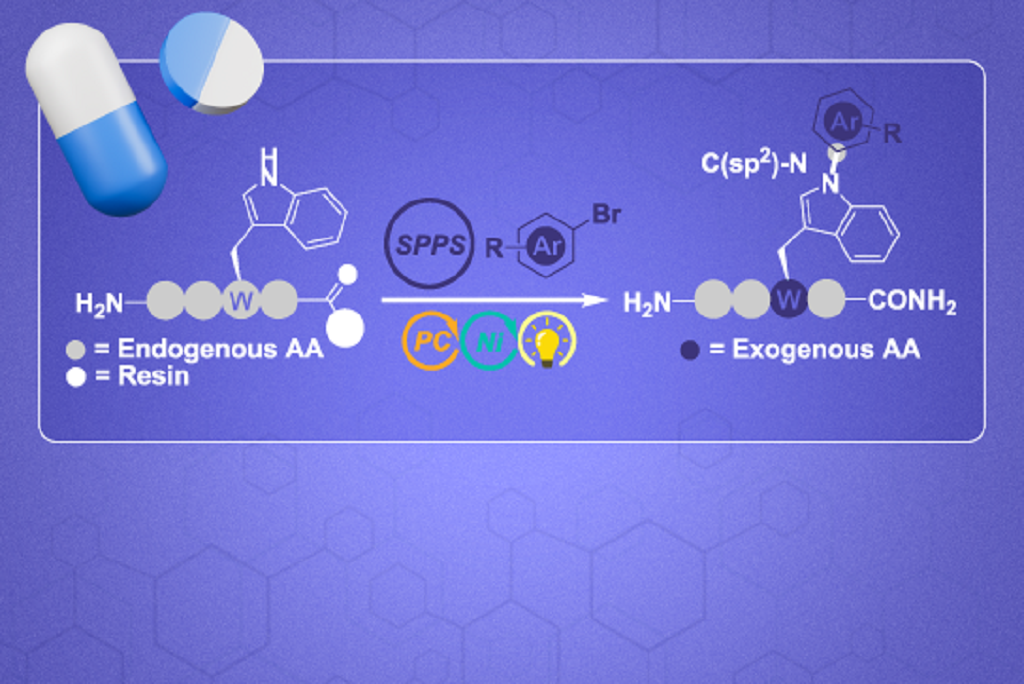
Metodologia inovadora de síntese e modificação de peptídeos visa aprimorar suas propriedades farmacológicas
Peptídeos são moléculas com um amplo espectro de ação biológica e, assim, imenso potencial para novas aplicações tecnológicas. Suas aplicações como fármacos, por exemplo, são bastante diversas, podendo abranger tratamentos para diferentes tipos de câncer, assim como de diabetes, dentre outras possibilidades. Apesar da fatia de mercado ocupada ainda ser pequena, é uma plataforma química que apresenta excelentes resultados, e o desenvolvimento de novas moléculas vem crescendo nas últimas duas décadas.
No entanto, a síntese química e modificações nessas moléculas - que despertam interesse crescente da indústria farmacêutica - ainda enfrentam grandes desafios. Cientistas da Universidade Federal de São Carlos (UFSCar), junto com colegas da Universidade de Regensburg, na Alemanha, acabam de compartilhar resultados que representam um passo significativo na ampliação das possibilidades de obtenção dessa importante classe de compostos.
Peptídeos, encontrados no nosso organismo e demais seres vivos, podem ser fabricados (sintetizados) quimicamente, em quantidade suficiente para a realização de pesquisas e posterior produção em escala industrial. Uma das estratégias empregadas, a síntese de peptídeos em fase sólida, rendeu o Prêmio Nobel de Química de 1984 a Robert Bruce Merrifield, dos Estados Unidos. Nela, aminoácidos, os "blocos" que, combinados em uma determinada sequência, produzem um peptídeo específico, vão sendo inseridos um após o outro. Na pesquisa da UFSCar, o grupo combinou essa rota a metodologia de catálise que emprega luz e metais (metallaphotocatalysis, no Inglês) para alterar cadeias laterais de aminoácidos de forma precisa e, assim, buscar as propriedades que viabilizem a utilização clínica desses compostos.
Outras técnicas já são investigadas com essa mesma finalidade. No entanto, a metodologia empregada no estudo da UFSCar realiza modificações sem afetar outras partes essenciais dos peptídeos. Em laboratório, um catalisador metálico e um fotossensibilizador são incorporados a um sistema reacional contendo o peptídeo selecionado, que em seguida é exposto à luz, permitindo assim a inserção seletiva de novas porções ao peptídeo.
"Esta é uma técnica avançada para modificar, de forma simples, moléculas complexas. O conceito da seletividade é essencial neste cenário. Por exemplo: se um determinado peptídeo é composto por 21 aminoácidos, em nossa técnica, apenas um deles se modifica. Essa modificação seletiva, além de melhorar a eficácia dos peptídeos, preserva as suas propriedades originais", explica Márcio Weber Paixão, docente no Departamento de Química (DQ) da UFSCar e um dos pesquisadores responsáveis pelo estudo.
Os chamados fármacos peptídicos têm, dentre as suas vantagens, a alta seletividade e especificidade - que permitem atacar um alvo desejado sem afetar outros tecidos ou órgãos - e a baixa imunogenicidade. De outro lado, ainda apresentam pontos fracos como pouca estabilidade, tempo curto de circulação no organismo e baixa biodisponibilidade, desafios a serem enfrentados justamente por essas novas possibilidades de intervenção visando o aprimoramento de suas propriedades farmacológicas.
"Ao avaliarmos o protocolo em diferentes tipos de peptídeos, detectamos que ele funcionou em várias situações, mesmo nas mais complexas, indicando a sua versatilidade e o potencial para o desenvolvimento de moléculas bioativas mais eficazes", reforça Paixão. O pesquisador registra que, além da aplicação para a saúde humana, outras aplicações potenciais dizem respeito à área veterinária e ao desenvolvimento de novos agroquímicos.
O pesquisador registra como o resultado atual, de ciência básica, tem ao mesmo tempo grande potencial e um caminho a percorrer até chegar à aplicação. A história da plataforma de produção de vacinas a partir de RNA mensageiro (mRNA), que nos levou à vacina contra a Covid-19 em tempo recorde, ajuda a entender esse percurso. No ano passado, Katalin Karikó e Drew Weissman receberam o Prêmio Nobel de Medicina e Fisiologia por descobertas fundamentais sobre a interação entre o mRNA e o sistema imune publicadas em 2005 (com aprofundamentos em 2008 e 2010). Ou seja, 15 anos se passaram entre os primeiros resultados de um trabalho iniciado muito antes, no início dos anos 1990, e sua aplicação na vacina que nos tirou da pandemia.
Os resultados da pesquisa reportada foram publicados em artigo científico no Journal of the American Chemical Society, que pode ser acessado em bit.ly/sintese-peptideos. Assinam a publicação, além de Paixão, José A. C. Delgado, estudante de doutorado do Programa de Pós-Graduação em Química (PPGQ) da UFSCar; Burkhard König, Ya-Ming Tian e Michela Marcon, cientistas atuantes na Universidade de Regensburg.
O estudo contou com financiamento da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes, processo nº 88887.569938/2020-00), do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, processos nº 444061/2018-5 e nº 405052/2021-9) e da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp, processo nº 2021/06099-5. Na Alemanha, também teve apoio da Fundação Alemã de Ciência (DFG).
No entanto, a síntese química e modificações nessas moléculas - que despertam interesse crescente da indústria farmacêutica - ainda enfrentam grandes desafios. Cientistas da Universidade Federal de São Carlos (UFSCar), junto com colegas da Universidade de Regensburg, na Alemanha, acabam de compartilhar resultados que representam um passo significativo na ampliação das possibilidades de obtenção dessa importante classe de compostos.
Peptídeos, encontrados no nosso organismo e demais seres vivos, podem ser fabricados (sintetizados) quimicamente, em quantidade suficiente para a realização de pesquisas e posterior produção em escala industrial. Uma das estratégias empregadas, a síntese de peptídeos em fase sólida, rendeu o Prêmio Nobel de Química de 1984 a Robert Bruce Merrifield, dos Estados Unidos. Nela, aminoácidos, os "blocos" que, combinados em uma determinada sequência, produzem um peptídeo específico, vão sendo inseridos um após o outro. Na pesquisa da UFSCar, o grupo combinou essa rota a metodologia de catálise que emprega luz e metais (metallaphotocatalysis, no Inglês) para alterar cadeias laterais de aminoácidos de forma precisa e, assim, buscar as propriedades que viabilizem a utilização clínica desses compostos.
Outras técnicas já são investigadas com essa mesma finalidade. No entanto, a metodologia empregada no estudo da UFSCar realiza modificações sem afetar outras partes essenciais dos peptídeos. Em laboratório, um catalisador metálico e um fotossensibilizador são incorporados a um sistema reacional contendo o peptídeo selecionado, que em seguida é exposto à luz, permitindo assim a inserção seletiva de novas porções ao peptídeo.
"Esta é uma técnica avançada para modificar, de forma simples, moléculas complexas. O conceito da seletividade é essencial neste cenário. Por exemplo: se um determinado peptídeo é composto por 21 aminoácidos, em nossa técnica, apenas um deles se modifica. Essa modificação seletiva, além de melhorar a eficácia dos peptídeos, preserva as suas propriedades originais", explica Márcio Weber Paixão, docente no Departamento de Química (DQ) da UFSCar e um dos pesquisadores responsáveis pelo estudo.
Os chamados fármacos peptídicos têm, dentre as suas vantagens, a alta seletividade e especificidade - que permitem atacar um alvo desejado sem afetar outros tecidos ou órgãos - e a baixa imunogenicidade. De outro lado, ainda apresentam pontos fracos como pouca estabilidade, tempo curto de circulação no organismo e baixa biodisponibilidade, desafios a serem enfrentados justamente por essas novas possibilidades de intervenção visando o aprimoramento de suas propriedades farmacológicas.
"Ao avaliarmos o protocolo em diferentes tipos de peptídeos, detectamos que ele funcionou em várias situações, mesmo nas mais complexas, indicando a sua versatilidade e o potencial para o desenvolvimento de moléculas bioativas mais eficazes", reforça Paixão. O pesquisador registra que, além da aplicação para a saúde humana, outras aplicações potenciais dizem respeito à área veterinária e ao desenvolvimento de novos agroquímicos.
O pesquisador registra como o resultado atual, de ciência básica, tem ao mesmo tempo grande potencial e um caminho a percorrer até chegar à aplicação. A história da plataforma de produção de vacinas a partir de RNA mensageiro (mRNA), que nos levou à vacina contra a Covid-19 em tempo recorde, ajuda a entender esse percurso. No ano passado, Katalin Karikó e Drew Weissman receberam o Prêmio Nobel de Medicina e Fisiologia por descobertas fundamentais sobre a interação entre o mRNA e o sistema imune publicadas em 2005 (com aprofundamentos em 2008 e 2010). Ou seja, 15 anos se passaram entre os primeiros resultados de um trabalho iniciado muito antes, no início dos anos 1990, e sua aplicação na vacina que nos tirou da pandemia.
Os resultados da pesquisa reportada foram publicados em artigo científico no Journal of the American Chemical Society, que pode ser acessado em bit.ly/sintese-peptideos. Assinam a publicação, além de Paixão, José A. C. Delgado, estudante de doutorado do Programa de Pós-Graduação em Química (PPGQ) da UFSCar; Burkhard König, Ya-Ming Tian e Michela Marcon, cientistas atuantes na Universidade de Regensburg.
O estudo contou com financiamento da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes, processo nº 88887.569938/2020-00), do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, processos nº 444061/2018-5 e nº 405052/2021-9) e da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp, processo nº 2021/06099-5. Na Alemanha, também teve apoio da Fundação Alemã de Ciência (DFG).

